Możliwości poprawy parametrów hipertermii w krążeniu kończynowym u chorych poddanych regionalnej perfuzji kończynowej z powodu czerniaka poprzez podanie bupiwakainy do przestrzeni zewnątrzoponowej
Streszczenie
Cel pracy:
Niniejsza praca miała na celu przedstawienie własnej modyfikacji tej techniki zabiegu, mającej na celu uzyskanie właściwych parametrów leczniczych. Polegała ona na podaniu do przestrzeni zewnątrzoponowej roztworu bupiwocainy w celu rozszerzenia łożyska naczyniowego kończyn dolnych i, poprzez ten mechanizm, uzyskanie lepszych parametrów miejscowej hypertermii, co mogłoby zwiększyć efekt terapeutyczny zabiegu chemioterapii perfuzyjnej kończyny.
Materiał:
W latach 1996 – 2004 w Klinice Chirurgii Onkologicznej wykonano 32 zabiegi kończynowej chemioterapii perfuzyjnej w hypertermii (KCPH), u chorych z obecnymi przerzutami in-transit (26 chorych), ze wznową czerniaka po radykalnym wycięciu (4 chorych) oraz u pozostałych dwóch chorych jako leczenie uzupełniające zabieg wycięcia mięsaków tkanek miękkich po wycięciu z marginsem brzeżnym. U 23 chorych wykonano zabieg w warunkach podwyższonej temperatury z zastosowaniem melphalanu. W badanej grupie był 15 kobiet i 8 mężczyzn. Wiek chorych wynosił średnio 57,2 lat (od 26 do 72 lat).
Metoda:
Podając do przestrzeni zewnątrzoponowej bupiwakainę uzyskiwano blokadę współczulną z następowym rozszerzeniem naczyń krwionośnych. 0,25% bupiwakainę (bupivacainum hydrochloricum, Polfa, Warszawa, Polska) podawano po 30 minutach od rozpoczęcia krążenia pozaustrojowego do założonego cewnika do ZOP w ilości 10 cm3. Pomiarów temperatury dokonywano w 15-minutowych odstępach czasu.
Wyniki:
Zaobserwowano wyraźny wpływ zastosowania bupiwakainy na poprawę parametrów termicznych skóry podudzia, co ma szczególne znaczenie przy obecności przerzutów in-transit w tej okolicy. Rozszerzenie łożyska naczyniowego po podaniu bupiwakainy do przestrzeni zewnątrzoponowej poprawia ogrzanie wszystkich warstw kończyny, a w szczególności tkanki podskórnej i skóry, które są celem leczenia za pomocą zabiegu chemioterapii perfuzyjnej z użyciem melphalanu.
Wstęp
Rokowanie w czerniaku złośliwym zależy głównie od grubości zmiany pierwotnej oraz stanu regionalnych węzłów chłonnych (1). Standardowym sposobem leczenia czerniaka nadal pozostaje zabieg operacyjny, zarówno w przypadku leczenia ogniska pierwotnego jak i przerzutów do węzłów chłonnych. Specyficzną sytuacją kliniczną jest występowanie przerzutów in-transit, będących wynikiem wzrostu nowotworu w naczyniach chłonnych oraz najbliższych tkankach okolicy występowania ogniska pierwotnego. Częstość przerzutów in-transit u chorych z czerniakiem kończyn wynosi około 10% i występuje częściej w przypadku zajęcia przez przerzuty regionalnych węzłów chłonnych (1).
Standardowym leczeniem może być chirurgiczne wycinanie pojedynczych zmian lub miejscowo stosowana radioterapia. Żadna z tych metod nie ma jednak wartości jako leczenie kompleksowe istniejących i potencjalnych zmian przerzutowych w skórze i tkance podskórnej.
Metodą, za pomocą której można uzyskać poprawę wyników w zakresie leczenia miejscowego jest chemioterapia perfuzyjna w hypertermii. Została ona po raz pierwszy zastosowana przez Creecha w 1959 (2) i Stehlina w 1960 roku (3). Nowością w tych zabiegach było wyizolowanie kończyny z krążenia systemowego, co pozwoliło na zastosowanie wyższych aniżeli standardowe dawek leków przeciwnowotworowych. W 1967 Cavaliere wykonał chemioterapię perfuzyjna w warunkach podwyższonej temperatury, ustalając w ten sposób standard postępowania, którego ogólne zarysy są w zabiegach wykonywanych obecnie (4).
W Polsce pierwsze zabiegi perfuzji kończynowej wykonał Meyza i wsp. (5). Były to zabiegi wykonywane w tzw. „łagodnej” hipertermii, którą Meyza zastosował na 4 lata przed pracą Cavaliere (5). Niestety, badanie nie było kontynuowane i na wiele lat zniknęło z arsenału polskiej chirurgii. W standardzie techniki stosowanej współcześnie, z zastosowanie „prawdziwej” hipertermii i wskazań ograniczonych do istniejących przerzutów in-transit zabieg zastosował w Polsce Kopacz i Jastrzębski w 1995 roku. Są one wykonywane jako standardowe postępowanie w konkretnych stanach klinicznych, do których należą wspomniane przerzuty in-transit oraz leczenie uzupełniające po nieradyklanie wyciętym mięsaku kończyn (6).
Zabiegi perfuzji kończynowej są wykonywane w warunkach krążenia pozaustrojowego, z wykorzystaniem oxygenatora, w celu stałego utlenowania krwi w trakcie perfuzji. Dodatkowo krew jest ogrzewana do temperatury od 37,0°C do 42,0°C. W zależności od zastosowanej temperatury wyróżniamy zabiegi wykonywane w warunkach normotermii (37-38°C), „łagodnej” hipertermii (38-40°C), „granicznie prawdziwej” hipertermii (40,0-41,0°C) oraz „prawdziwej” hipertermii (> 41,5°C) (7,8,9)
Najważniejszym czynnikiem rokowniczym u chorych poddanych zabiegowi perfuzji kończynowej jest uzyskanie całkowitej remisji zmian nowotworowych (10). Zależy to nie tylko od zastosowanych leków przeciwnowotworowych, ale także od temperatury perfundowanej kończyny. Zabiegi wykonywane w temperaturze kończyny 40,0 - 41,5°C są bardziej skuteczne aniżeli wykonywane w temperaturach niższych (9). Dlatego tak ważne jest zastosowanie odpowiedniej techniki, umożliwiającej osiągnięcie tej temperatury perfuzji.
Niniejsza praca miała na celu przedstawienie własnej modyfikacji tej techniki zabiegu, mającej na celu uzyskanie właściwych parametrów leczniczych. Polegała ona na podaniu do przestrzeni zewnątrzoponowej roztworu bupiwocainy w celu rozszerzenia łożyska naczyniowego kończyn dolnych i, poprzez ten mechanizm, uzyskanie lepszych parametrów miejscowej hypertermii, co mogłoby zwiększyć efekt terapeutyczny zabiegu chemioterapii perfuzyjnej kończyny.
Materiał
W latach 1996 – 2004 w Klinice Chirurgii Onkologicznej wykonano 32 zabiegi kończynowej chemioterapii perfuzyjnej w hypertermii (KCPH), u chorych z obecnymi przerzutami in-transit (26 chorych), ze wznową czerniaka po radykalnym wycięciu (4 chorych) oraz u pozostałych dwóch chorych jako leczenie uzupełniające zabieg wycięcia mięsaków tkanek miękkich po wycięciu z marginsem brzeżnym. U 23 chorych wykonano zabieg w warunkach podwyższonej temperatury z zastosowaniem melphalanu (Alkeran, GlaxoSmithKline Export). Pozostałych 9 chorych otrzymało melphalan i rTNF (kachektyna) i byli oni wykluczeni z badania, ze względu na możliwość zmian metabolicznych w obrębie kończyny po zastosowaniu TNF, co mogłoby wpływać na wyniki badania.
W badanej grupie był 15 kobiet i 8 mężczyzn. Wiek chorych wynosił średnio 57,2 lat (od 26 do 72 lat). U wszystkich chorych przed zabiegiem wykonano badania diagnostyczne w celu potwierdzenia wydolności układu krążenia, układu oddechowego i moczowego. Stan ogólny wszystkich pacjentów oceniany według skali Karnofsky’ego wynosił powyżej 70 pkt.
Chorych podzielono na dwie Grupy, w zależności od tego, czy zastosowano jedynie znieczulenie ogólne ( Grupa II Kontrolna – 10 chorych) czy znieczulenie kombinowane z wprowadzeniem cewnika do przestrzeni zewnątrzoponowej ( ZOP) ( Grupa I – 13 chorych).
Do grupy I kwalifikowano chorych u których nie stwierdzono przeciwwskazań do zastosowania znieczulenia ZOP, a także uzyskano od nich zgodę na wprowadzenie cewnika do ZOP. Cewnik wprowadzano na wysokości L2/L3 lędżwiowego odcinka kręgosłupa i podprowadzano go na wysokość 4 cm do kanału kręgowego. Z uwagi na konieczność stosowania wysokich dawek heparyny, cewnik wprowadzano 6 do 8 godzin przed zabiegiem operacyjnym. Podając do przestrzeni zewnątrzoponowej bupiwakainę uzyskiwano blokadę współczulną z następowym rozszerzeniem naczyń krwionośnych. 0,25% bupiwakainę (bupivacainum hydrochloricum, Polfa, Warszawa, Polska) podawano po 30 minutach od rozpoczęcia krążenia pozaustrojowego do założonego cewnika do ZOP w ilości 10 cm3. Pomiarów temperatury dokonywano w 15-minutowych odstępach czasu.
Metoda
Metoda została opisana przez nas uprzednio (6). W skrócie polega ona na izolacji kończyny z krążenia ogólnoustrojowego i prowadzenia krążenia pozaustrojowego poprzez oksygenator i układ drenów zewnętrznych, wprowadzonych do krążenia kończynowego poprzez naczynia żylne (żyła udowa, biodrowa zewnętrzna) i tętnicze (tętnica udowa powierzchowna, biodrowa zewnętrzna). Przed założeniem drenów podaje się heparynę ogólnustrojowo.
W celu ograniczenia przecieku żylnego drogą naczyń leżących w tkance podskórnej i skórze zakładane są opaski uciskowe (Esmarcha) powyżej założonych drenów do naczyń krwionośnych. Krew jest rozcieńczana do wartości hematokrytu 24 w celu zmniejszenia oporów w krążeniu włosowatym oraz ogrzewana w wymienniku ciepła do temperatury 40,0 – 41,5°C. Temperatura płynu grzewczego wynosiła 42°C.
Szybkość krążenia perfuzyjnego wynosiła 500 – 1200 ml/min. Przeciek pomiędzy krążeniem kończynowym i systemowym jest mierzony metodą izotopową z wykorzystaniem radioaktywnego izotopu technetu o aktywności 10 mCi, podawanego do krążenia kończynowego dotętniczo. Pomiar wielkości przecieku wykonywany jest po 15 minutach od podania izotopu za pomocą zliczania impulsów promieniowania oraz w sposób za pomocą ręcznego detektora promieniowania gamma (NeoProbe, AutoSuture, USA) umieszczonego przedsercowo nad mostkiem chorego.
Kończyna była izolowana termicznie za pomocą materaca z gąbki poliuretanowej oraz materaca żelowego. Ze względu na aspekt techniczny zabiegu (pole operacyjne w okolicy pachwiny), izolacja cieplna w pełnym zakresie była możliwa od wysokości 2/3 górnej kończyny.
Po uzyskaniu zadanych parametrów temperatury kończyny, podawany był melphalan (Alkeran, Wellcome, UK) w dawce 1,5 mg/kg m.c., w trzech równych dawkach, co 10 min każda. Czas krążenia cytostatyku od momentu podania wynosił 90 minut. Po tym okresie wykonywano płukanie kończyny podając dotętniczo 2L płynu Ringera, oraz uzupełniano krążenie kończynowe roztworem albumin i jedną jednostką (500 ml) krwi.
Temperatura kończyn była mierzona w okresach 15 minutowych od początku zabiegu do usunięcia drenów. Pomiarów dokonywano zarówno na udzie jak i podudziu, mierząc temperaturę skóry, tkanki podskórnej oraz mięśni. Do tego celu używano termometrów igłowych (MKA-08050-A i MKG-09500-A ) oraz kulkowych (MRB-04020-A - do pomiarów temperatury skóry) (Ellab A/S Dania).
Wyniki
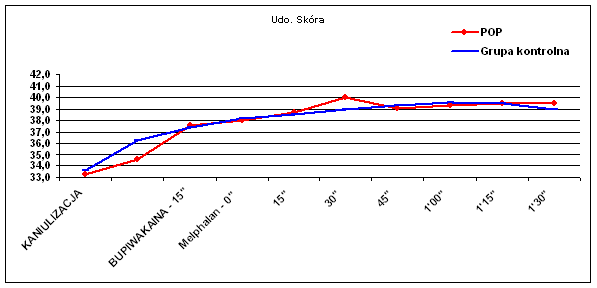
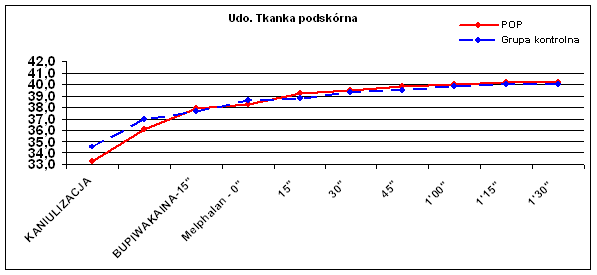
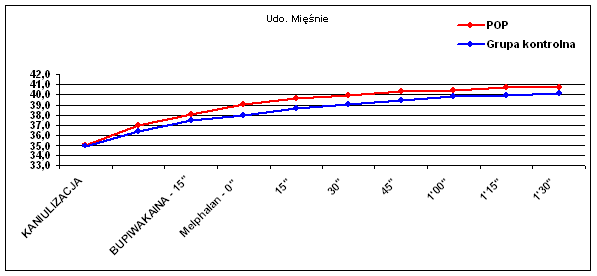
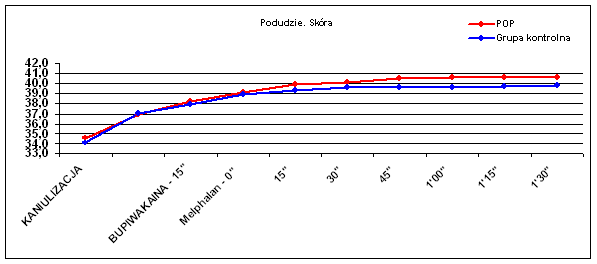
Dane temperaturowe uzyskano od wszystkich chorych, którym wykonano zabieg chemioterapii perfuzyjnej kończyn. Oceniano porównawczo temperaturę skóry uda (Ryc.1), tkanki podskórnej uda (Ryc.2), mięśni uda (Ryc.3), skóry podudzia (Ryc.4), tkanki podskórnej podudzia (Ryc.5) i mięśni podudzia (Ryc.6).
Analizę statystyczną przeprowadzono w zakresie temperatur uzyskanych na 15 minut przed podaniem Melphalanu, od momentu podania bupiwakainy (Grupa I), lub analizując przebieg temperaturowy zabiegu, na 15 minut przed podaniem cytostatyku (Grupa II Kontrolna), w celu oceny różnicy wyników w czasie bezpośredniej chemioterapii perfuzyjnej.
W ocenie pomiarów temperatury skór uda nie uzyskano znaczącej różnicy pomiędzy badanymi grupami chorych (p=0.35). Dodatni trend, aczkolwiek także nieznamienny statystycznie (p=0.08) zaobserwowano w pomiarach temperatury tkanki podskórnej uda.
Ryc. 1 Temperatura skóry uda.
Ryc. 2 Temperatura tkanki podskórnej uda.
Ryc. 3 Temperatura mięśni uda.
Ryc. 4 Temperatura skóry podudzia.
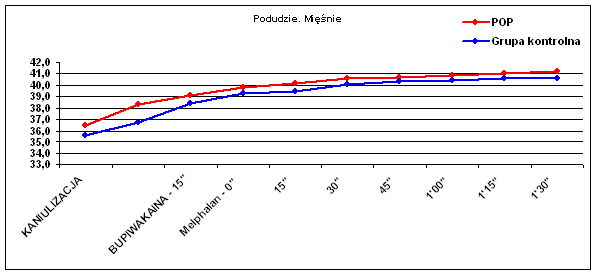
Ryc. 5 Temperatura tkanki podskórnej podudzia.
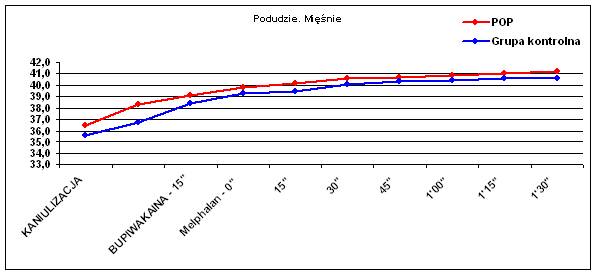
Ryc. 6 Temperatura mięśni podudzia.
Podobny trend występował w różnicy temperatur skóry podudzia (p=0.057), lecz nie w tkance podskórnej podudzia (p=0.44). Obserwowano natomiast wyraźną zmianę temperatury mięśni zarówno uda (p=0.009) jak i podudzia (p=0.006), co widać także w wynikach średnich temperatur (Tab. I).
| Grupa I | Start | -15” B | 0”- M | 15” | 30” | 45” | 1’00” | 1’15” | 1’30” | |
|---|---|---|---|---|---|---|---|---|---|---|
| Udo - skóra | 33,3 | 34,6 | 37,6 | 38,0 | 38,7 | 40,0 | 39,1 | 39,3 | 39,5 | 39,5 |
| Udo – tkanka podskórna | 33,3 | 36,1 | 37,9 | 38,3 | 39,2 | 39,5 | 39,8 | 40,0 | 40,2 | 40,2 |
| Udo - mięśnie | 35,1 | 37,0 | 38,1 | 39,1 | 39,7 | 39,9 | 40,3 | 40,4 | 40,7 | 40,7 |
| Podudzie - skóra | 34,6 | 37,0 | 38,2 | 39,1 | 39,9 | 40,1 | 40,5 | 40,6 | 40,6 | 40,6 |
| Podudzie – tk. podskórna | 35,2 | 37,6 | 38,6 | 39,5 | 40,3 | 40,4 | 40,6 | 40,8 | 40,8 | 41,1 |
| Podudzie - mięśnie | 36,5 | 38,3 | 39,1 | 39,8 | 40,2 | 40,6 | 40,7 | 40,9 | 41,0 | 41,2 |
| Grupa II | Start | -15” B | 0”- M | 15” | 30” | 45” | 1’00” | 1’15” | 1’30” | |
| Udo - skóra | 33,6 | 36,3 | 37,4 | 38,2 | 38,5 | 39,0 | 39,3 | 39,6 | 39,5 | 39,0 |
| Udo – tkanka podskórna | 34,6 | 37,0 | 37,7 | 38,6 | 38,8 | 39,3 | 39,5 | 39,8 | 40,0 | 40,0 |
| Udo - mięśnie | 35,0 | 36,4 | 37,5 | 38,0 | 38,7 | 39,1 | 39,5 | 39,8 | 39,9 | 40,1 |
| Podudzie - skóra | 34,1 | 37,1 | 37,9 | 38,9 | 39,3 | 39,6 | 39,6 | 39,6 | 39,7 | 39,8 |
| Podudzie – tk. podskórna | 34,9 | 37,4 | 38,7 | 39,3 | 39,9 | 40,1 | 40,3 | 40,4 | 40,6 | 40,6 |
| Podudzie - mięśnie | 35,6 | 36,8 | 38,4 | 39,3 | 39,5 | 40,1 | 40,3 | 40,4 | 40,6 | 40,6 |
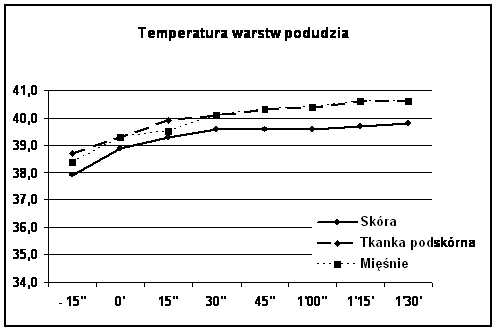
Ryc. Mięśnie/Tkanka podskórna vs Skóra: p=0.048
Należy zwrócić także uwagę na różnice wyjściowe temperatur poszczególnych warstw kończyny w momencie rozpoczęcia krążenia pozaustrojowego. W izolowanym szczelnie podudziu temperatury te były wyższe zarówno na powierzchni skóry jak, w tkance podskórnej i w mięśniach w stosunku do skóry, tkanki podskórnej i mięśni uda średnio o 1°C (33,0°C vs 34,5°C ; 34,0°C vs 35,0°C i 35,0°C vs 36,0°C).
Zaobserwowano statystycznie znamienną (p=0.048) różnicę temperatury pomiędzy mięśniami i tkanką podskórną a skórą podudzia w Grupie II Kontrolnej. Różnica wynosiła średnio 0,67°C (od 0,4 do 0,9) w trakcie perfuzji po podaniu cytostatyku. Temperatura skóry była niższa od temperatury głębszych tkanek podudzia i nie przekroczyła 39,9°C. Takiej różnicy temperatur nie obserwowano u chorych w Grupie I, którym przed podaniem cytostatyku podano bupiwakainę do przestrzeni zewnątrzoponowej. Różnica temperatur pomiędzy mięśniami a tkanką podskórną wynosiła średnio 0,26°C i nie była statystycznie istotna (p=0,99), zaś temperatura skóry podudzia wynosiła 40,0 – 40,6°C.
Wnioski
Zaobserwowano wyraźny wpływ zastosowania bupiwakainy na poprawę parametrów termicznych skóry podudzia, co ma szczególne znaczenie przy obecności przerzutów in-transit w tej okolicy. Rozszerzenie łożyska naczyniowego po podaniu bupiwakainy do przestrzeni zewnątrzoponowej poprawia ogrzanie wszystkich warstw kończyny, a w szczególności tkanki podskórnej i skóry, które są celem leczenia za pomocą zabiegu chemioterapii perfuzyjnej z użyciem melphalanu.
Dyskusja
Hipertermia, obok stosowanych w zabiegu chemioterapii perfuzyjnej leków przeciwnowotworowych, jest czynnikiem leczniczym ze względu na poprawę skuteczności działania cytostatyków jak i poprzez uszkadzający wpływ na komórki nowotworowe. Wpływ ten jest tym większy, im wyższa jest zastosowana temperatura (7). W piśmiennictwie spotyka się opracowania dotyczące zabiegów perfuzji kończynowej z wykorzystaniem różnych temperatur. Eggermont (9) podaje w zestawieniu prace opisujące zabiegi wykonywane w normotermii (37-38°C), łagodnej hipertermii (39-40°C), granicznej hipertermii prawdziwej (40-41°C) i hipertermii prawdziwej (powyżej 41°C). Prace pochodzą głównie z lat 80-tych i 90-tych, gdzie podstawowym lekiem stosowanym w perfuzji był sam melphalan. Skuteczność tego sposobu leczenia była zależna od osiągniętych parametrów termicznych i wyższa po zabiegach z wykorzystaniem prawdziwej hipertermii aniżeli w niższych temperaturach (87-100% CR+PR vs 65-100 CR+PR) (9). W roku 1992 i 1993 Lienard i Lejeune opublikowali wyniki leczenia chorych z czerniakiem skóry za pomocą perfuzji kończynowej z wykorzystaniem rTNF (tumor necrosis factor) i melphalanu (11,12), uzyskując znamiennie lepsze efekty aniżeli po zastosowaniu samego melphalanu. Jednak zastosowane temperatury były niższe (38-40°C) aniżeli w zabiegach wykonywanych w „prawdziwej” hipertermii, ze względu na możliwość wystąpienia miejscowych powikłań toksycznych po skojarzonym leczeniu za pomocą wysokiej temperatury i rTNF. W przypadku zastosowania temperatury niższej niż 40°C częstość powikłań miejscowych jest podobna zarówno po zastosowaniu samego melphalanu jaki i w połączeniu z rTNF (13). Powikłania miejscowe, jak np. obrzęk kończyny, wymagający niekiedy wykonania fasciotomii, są związane z zastosowaną temperaturą ogrzewanych tkanek i wzrastają po podaniu do ogrzanych tkanek leków przeciwnowotworowych (14).
Leczenie przerzutów in-transit czerniaka oraz zaawansowanych miejscowo mięsaków za pomocą kończynowej chemiotrapii perfuzyjnej z zastosowaniem rTNF i melphalanu daje obecnie najlepsze wyniki (15,16).
Jednak perfuzja z zastosowaniem rTNF jest obarczona różnymi ogólnoustrojowymi powikłaniami toksycznymi, mogącymi doprowadzić do niewydolności krążeniowo-oddechowej (13,17,18). Występują one częściej, gdy przeciek pomiędzy krążeniem kończynowym a ogólnoustrojowym jest większy aniżeli 1% (17), a szczególnie powyżej 10% (19).
W licznych pracach podających wielkość przecieku, wynosi on od 1% do 21% (8, 19). W naszym materiale przeciek wynosił średnio 4,9% (od 1% do 15%). Zastosowanie wysokich dawek rTNF w warunkach zwiększonego przecieku może doprowadzić do wystąpienia poważnych powikłań (18). Z drugiej strony, co przedstawiono powyżej, zabiegi z użyciem samego melphalanu są mniej skuteczne, nawet pomimo zastosowania warunków hipertermii.
Opublikowane w ostatnich latach prace de Wilta (20) i Thompsona (21) rzucają nowe światło na zastosowanie melphalanu w zabiegu perfuzji kończynowej. De Wilt wykazał, że stężenie melphalanu w guzie nowotworowym zwiększa się po zastosowaniu rTNF, podczas gdy stężenie cytostatyku, także po podaniu kachektyny, nie zwiększa się w skórze i mięśniach. Zabiegi były wykonywane w temperaturze 38-39°C (łagodna hipertermia). Spostrzeżenie to potwierdzają wyniki badań Thompsona i wsp., którzy wykazali, że przy podaniu melphalanu dotętniczo jego stężenie w tkankach zdrowych kończyny i guzie nowotworowym jest podobne. Badanie było przeprowadzone z wykorzystaniem mikrodializy w badanych tkankach, po pozwoliło ocenić stężenie cytostatyku w trakcie perfuzji.
Mając na uwadze różne wyniki leczenia po zastosowaniu perfuzji kończynowej z samym melphalanem w różnych warunkach termicznych (9), oraz fakt, że hipertermia jest uznanym czynnikiem skojarzonego leczenia perfuzyjnego, postanowiliśmy dokładnie przyjrzeć się pomiarom temperatury w zabiegach z wykorzystaniem samego melphalanu.
Analiza artykułów, w których podano rozmieszczenie termometrów wykazało, że istnieją duże różnice zarówno w wykonanych pomiarach jak i wartościach temperatury, będących sygnałem do podania cytostatyku w trakcie perfuzji kończynowej. W licznych pracach widoczne są różnice w umieszczeniu czujników temperatury, co powoduje, że pomiary te mogą nie być wiarygodne w badaniach porównawczych. Pomiar dokonywany jest w tkance podskórnej (22,23,24), mięśniach (14,19,25) lub jednocześnie w mięśniach i tkance podskórnej (26,27). Różne są także wskazania do rozpoczęcia chemioterapii perfuzyjnej poprzez podanie cytostatyku. Podanie temperatury zabiegu 40-41,5 °C jako wykonywanej w warunkach hypertermii, nie uwzględnia miejsca jej zastosowania w poszczególnych warstwach kończyny i jest oceną bardzo ogólną (7). Stąd też duże różnice w pracach, które podają wykonanie zabiegu w warunkach hiperetrmii. Krementz (22), Vrouenraets (24) i Hohenberger (14) zalecają podawanie cytostatyku, gdy tkanka podskórna ogrzeje się do 38°C. Inni sugerują się temperaturą mięśni, ale także wśród nich nie ma jednakowego podejścia. Vaglini (25) i Doryanani (7) uważają za moment rozpoczęcia krążenia melphalanu temperaturę 38°C, podczas gdy Vaglini podawał cytostatyk, gdy temperatura mięśni osiągnęła 40,5-41,0°C (25). Ciekawe wyniki badania randomizowanego przedstawił Ghussen w 1989 roku (26), który rozpoczynał krążenie cytostatyku, gdy temperatura zarówno mięśni jak i tkanki podskórnej na udzie i podudziu osiągnęła temperaturę 42°C. Warto zauważyć, że autor ten wykazał wyraźną poprawę kontroli miejscowej oraz przeżyć odległych u chorych leczonych zabiegiem chemioterapii perfuzyjnej w hypertermii jako leczenia uzupełniającego (chemoperfuzja profilaktyczne) po miejscowym wycięciu czerniaka. Badanie EORTC nie wykazało skuteczności chemoperfuzji profilaktycznej w zakresie wydłużenia przeżycia i mając na uwadze powikłania związane z tym typem zabiegu, nie jest obecnie zalecane w leczeniu czerniaka (28). Tutaj warto zauważyć, że zabiegi w ramach tego badania były wykonywane w tzw „łagodnej” hipertermii, zaś momentem rozpoczęcia podawania cytostatyku było uzyskanie temperatury 38-39°C w mięśniach i tkance podskórnej.
W naszym materiale wykazaliśmy różnicę temperatur pomiędzy poszczególnymi warstwami kończyny dolnej (skóra, tkanka podskórna, mięśnie) mierzonych zarówno na udzie jak i podudziu w trakcie całego zabiegu chemioterapii perfuzyjnej. Zaobserwowaliśmy statystycznie istotną różnicę pomiędzy mięśniami i tkanką podskórną z jednej strony a powierzchnią skóry z drugiej u chorych, którym wykonano perfuzję w standardowy sposób opisany przez większość cytowanych w pracy autorów. Sugeruje to, w świetle naszych wyników, że w przypadku przerzutów in-transit czerniaka w skórze ocena stopnia ogrzania tej warstwy kończyny nie jest w pełni wiarygodna w ocenie stopnia ogrzania tkanki podskórnej czy mięśni, jak to jest wykonywane przez większość autorów.
Zastosowanie bupiwakainy podawanej do przestrzeni zewnątrzoponowej w trakcie zabiegu perfuzji spowodowało podwójną korzyść. Po pierwsze podniosło temperaturę wszystkich warstw podudzia w stosunku do uda oraz, poprzez wyrównanie temperatur między warstwami kończyny, zmniejszyło różnicę temperatur pomiędzy skórą a tkanką podskórną i mięśniami, co pozwala na uzyskanie lepszych wartości grzewczych skóry pomimo zawężenia pomiarów temperatury do tkanki podskórnej i skóry. Istotna statystycznie poprawa poziomu temperatury mięśni uda i podudzia po bupiwakainie zwiększa możliwości lecznicze miejscowej hipertermii, aczkolwiek widoczna różnica pomiędzy temperaturami uda i podudzia wskazuje na niedostateczne ogrzanie kończyny przed perfuzją, spowodowane częściowym brakiem izolacji termicznej w trakcie preparowania tkanek przed założeniem kaniul do naczyń żylnych i tętniczych.
Wykazanie różnicy w ocenie temperatury skóry i głębszych tkanek powoduje, w naszym przekonaniu, potrzebę dokładnego pomiaru temperatury tych warstw skóry, w których istnieją ogniska nowotworu. Weryfikacja sposobu pomiaru temperatury tkanek może mieć wpływ zarówno na efekt terapeutyczny jak i zmodyfikowanie pojęcia „hipertermia”, które jest bardzo ogólne i dość dowolnie interpretowane przez różnych autorów. Jest to szczególnie ważne w rzetelnej ocenie wartości leczniczej chemioterapii perfuzyjnej w podwyższonej temperaturze przy zastosowaniu samego melphalanu.
Piśmiennictwo
- White R., Stanley W., Johnson J., Tyler D., Seigler H.: Long-term survival in 2,505 patients with melanoma with regional lymph node metastasis. Ann Surg 2002;235:879-887;
- Creech O,m Ryan R., Krementz E.: Treatment of malignant melanoma by isolation perfusion technique. JAMA 1959:169:339;
- Stehlin J., Clark R., White E. : Regional chemotherapy for cancer: experiences with 116 perfusuion. Ann Surg 1960;151:605;
- Cavaliere R., Ciocatto E., Giovanella B. Selective heat sensitivity of cancer cells. Biochemical and clinical study. Cancer 1967;20:351-
- Meyza J., Malinowski Z., Brzezińska-Werener H., Kołodziejski T., Kułakowski A., Niemand D.: Badania wartości i wskazań do leczenia nowotworów kończyn za pomocą perfuzji. Nowotwory, 1963;13:245-252;
- Kopacz A., Jastrzębski T., Świerblewski M., Rogowski J., Suchorzewska J., Kirkor Z., Las P., Romanowicz G., Myśliwska J., Sokołowski D., Trenkner M., Piotrowska J., Szymańska B.: Izolowana chemioterapia perfuzyjna kończyn w zaawansowanym miejscowo czerniaku oraz mięsaku tkanek miękkich. Pol Przegl Chir 1998;70:382-391;
- Kroon B.: Regional isolation perfusion in melanoma of the limbs; acomplishment, unsolved problems, future. Eur J Surg Oncol 1988;14:101-110;
- Sonnenveld E., Vrouenraets B., vanGeel B., Eggermont A., Klaase J., Nieweg O., vanDongen J., Kroon B.: Systemic toxicity after isolated limb perfusion with melphalan for melanoma. Eur J Surg Oncol 1996;22:521-527;
- Eggermont A.: Treatment of melanoma in0transit metastases confined to the limb. Cancer Surveys 1996;26:335-349;
- Bryant P., Balderson G., Mead P., Egerton W.: Hyperthermic isolated perfusion for malignant melanoma: response and survival. World J Surg 1995;19:363-368;
- Lienard D., Ewalenko P., Delmotte J-J., Renard N., Lejeune F.: High-dose recombinant tumor necrosis factor alpha in combination with interfeon-gamma and melphalan in isolation perfusion of the limbs for melanoma and sarcoma. J Clin Oncol 1992;10-52-60;
- Lejeune F., Lienard D., Leyvraz S., Mirimanoff R.: Regional therapy of melanoma. Eur J Cancer 1993;29:606-612;
- Thom A., Alexander R., Andrich M., Barker W., Rosenberg S., Fraker D.: Cytokine levels and systemic toxicity in patients undergoing isolated limb perfusion with high-dose tumor necrosis factor, interferon gamma and melphalan. J Clin Oncol 1995;13:264-27;
- Hohenberger P., Finke L., Schlag P.: Intracompartmental pressure during hyperthermic isolated limb perfusion for melanoma and sarcoma. Eur J Surg Oncol 1996;22:147-151;
- Eggermont A., Schrafford Koops H., Klausner J., Kroon B., Schlag P., Lienard J., vanGeel A., Hoekstra H., Meller I., Nieweg O., Kettelhack Ch., Ben-Ari G., Pector J-C., Lejeune F.: Isolated limb perfusion with tumor necrosis factor and melphalan for limb salvage in 186 patients with locally advanced soft tissue extremity sarcomas. Ann Surg 1996;224:756-765;
- Lienard D., Eggermont A., Koops S, Kroon B., Towse G., Hiemstra S., Schmitz P., Clarke J., Steinmann G., Rosenkaimer F., Lejeune F.: Isolated limb perfusion with tumour necrosis factor-alpha and melphalan with or without interferon-gamma for the treatment of in-transit melanoma metastases: a multicentre randomized phase II study. Melanoma Res. 1999;9:491-502;
- Thom A., Alexander R., Andrich M., Barker W., Rosenberg S., Fraker D.: Cytokine levels and systemic toxicity in patients undergoing isolated limb perfusion with high-dose tumor necrosis factor, interferon gamma and melphalan. J Clin Oncol 1995;13:264-273;
- Christoforidis D., Chassot P-G., Mosimann F., Lienard D., Brunstein F., Bejko D., Lejeune F., Chiolero R.: Isolated limb perfusion. Distinct Tourniquet and tumor necrosis factor effects on the early hemodynamic response. Arch Surg 2003;138:17-25;
- Daryanani D., Komdeur R., Ter Veen J., Nijhuis P., Piers D., Hoekstra H.: Continuous leakeage measurement during hyperthermic isolated limb perfusion. Ann Surg Oncol 2001;8:566-572;
- de Wilt J., Hagen T., de Boeck G., van Tiel S., Eggermont A.: Tumour necrosis factor alpha increases melphalan concentration in tumor tissue after isolated limb perfusion. Br J Cancer 2000;82:1000-1003;
- Thompson J., Siebert G., Anissimov Y., Smithers B., Doubrovsky A., Anderson C., Roberts M.: Microdialysis and response during regional chemotherapy by isolated infusion of melphalan for limb malignances. Br J Cancer 2001;85:157-165;
- Krementz E., Carter D., Sutherland C., Campbell M.: The use of regional chemotherapy in the management of malignant melanoma. World J Surg, 1979;3:289-304;
- Papa M., Klein E., Karni T., Kollr M., Davidson B., Aziz E., Ben-Ari G.: Regional hyperthermic perfusion with cisplatin following surgery for malignant melanoma of the extremities. Am J Surg 1996;171:416-420;
- Vrouenraets B., Kroon B., Klaase J., Nieweg O., van Slooten G., van Dongen J.: Severe acute regional toxicity after normothermic or „mild“ hyperthermic isolated limb perfusion with melphalan for melanoma. Melanoma Res 1995;5:425-431;
- Vaglini M., Santinami M., Nava M., Belli F., Prada A., Ammatuna M., Cascinelli N.: Hyperthermic antiblastic perfusion in extracorporeal circulation: surgicaltechnique and results in the treatment of extremities’ tumor. J Extra-Corporeal Techn 1986;18:12-20;
- Ghusen F., Kruger I., Smalley R., Groth W.: Hyperthermic perfusion with chemotherapy for melanoma of the extremities. World J Surg 1989;13:598-602;
- Skene A., Bulman A., Williams T., Thomas J., Westbury G.: Hyperthermic isolated perfusion with melphalan in the treatment of advanced malignant melanoma of the lower libm. Br J Surg 1990;77:765-767;
- Koops S., Vaglini M., Suciu S., Kroon B., Thompson J., Gohl J., Eggermont A., Di Fillipo F., Krementz E., Ruiter D., Lejeune F., on behalf EORTC Malignant Melanoma Cooperative Group Protocol 18832, the WHO Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 1998;16:2906:2912;